Saúde
Rede cobra que STF dê 72 horas para Anvisa autorizar o uso emergencial da Coronavac
Partido argumenta que a agência apresenta tratamento ‘desproporcional’ ao imunizante na comparação com a vacina de Oxford
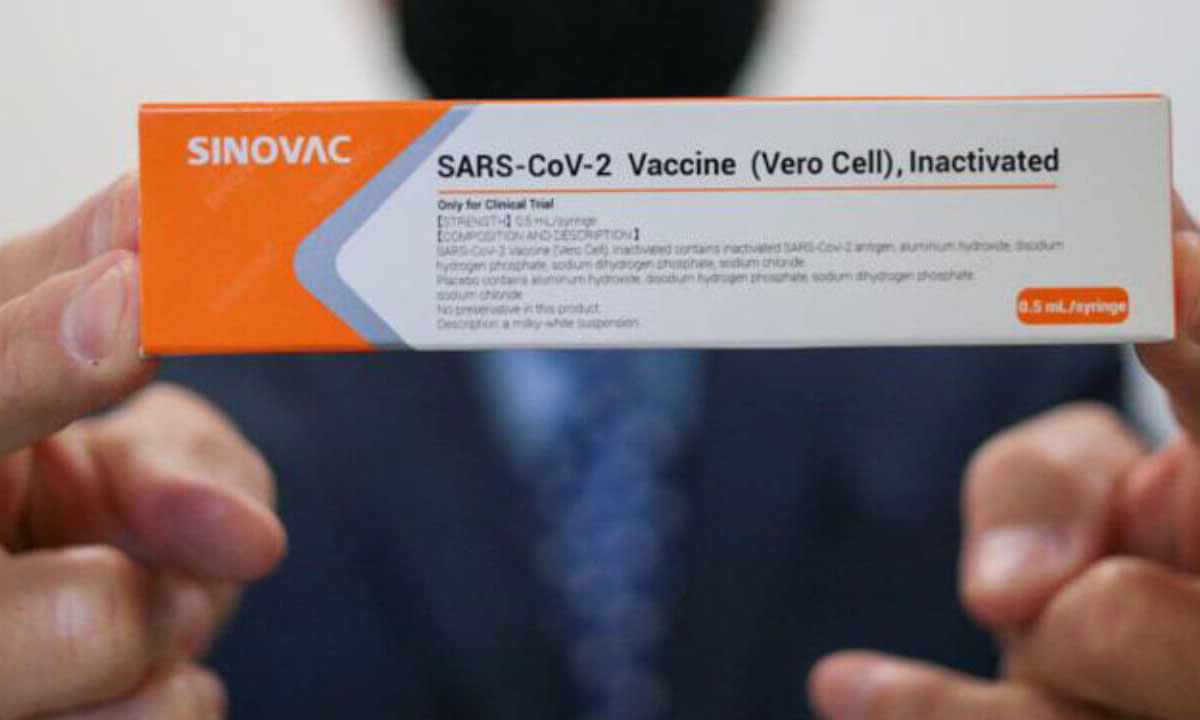
A Rede Sustentabilidade acionou o Supremo Tribunal Federal nesta segunda-feira 11 para que a Corte determine o prazo de 72 horas para a Agência Nacional de Vigilância Sanitária aprovar o uso emergencial da vacina Coronavac, produzida pelo Instituto Butantan em parceria com o laboratório chinês Sinovac. A agência trabalha com o prazo de dez dias para apresentar um parecer.
O pedido foi protocolado nesta tarde e será avaliado pelo ministro Ricardo Lewandowski. A sigla cobra que “seja determinado que a Anvisa apresente contestação cabal e fundamentada ao deferimento do registro da vacina Coronavac em 72h, findos os quais, in albis, seja concedido tacitamente o registro emergencial” e que, “caso haja objeção manifestada pela Anvisa, sejam designados peritos, numa equipe multidisciplinar, para que emitam parecer sobre os fundamentos da decisão”.
Na sexta-feira 8, o Butantan pediu à Anvisa a autorização para uso emergencial do imunizante. No sábado 9, a agência alegou que o instituto não enviou a documentação completa, mas que a análise da solicitação seguiria normalmente. No mesmo dia, a Anvisa informou que o pedido de uso emergencial da vacina de Oxford pela Fiocruz apresentou os “documentos preliminares e essenciais para avaliação detalhada”.
“Tal fato chamou a atenção do próprio Secretário de Saúde do Estado de São Paulo, na medida em que demonstra aparente condução desproporcional dos dois processos, que têm objetos e objetivos quase integralmente coincidentes: vacinar a população brasileira o quanto antes, para evitar mais mortes e efeitos deletérios desnecessários”, argumenta a Rede na ação protocolada no STF.
Ao justificar a determinação do prazo de 72 horas para aprovação do uso emergencial da Coronavac, a Rede sustenta que a vacina “já tinha sido aprovada para uso emergencial na China – cuja agência é expressamente citada pela Lei nº 13.979, de 6 de fevereiro de 2020 – (aliás, lá a aprovação se deu ainda em agosto de 2020) . No dia de hoje, a agência sanitária da Indonésia – um dos 4 outros países que estava procedendo ao teste mais amplo de eficácia do imunizante – autorizou o uso emergencial da CoronaVac“.
“E, mesmo que assim não fosse, certo é que a adoção do procedimento de análise no prazo de 72 horas é medida que se impõe por força do quanto já decidido por este Eg. Supremo Tribunal na ADPF 770. Naquela ocasião, restou consignado que se a Anvisa ‘não expedir a autorização competente, no prazo de 72 horas, [os Entes] poderão importar e distribuir vacinas registradas por pelo menos uma das autoridades sanitárias estrangeiras e liberadas para distribuição comercial nos respectivos países, conforme o art. 3°, VIII, a, e § 7°-A, da Lei 13.979/2020′”, completa a sigla.
Segundo anúncio do governo de São Paulo, os resultados da fase três dos testes clínicos da Coronavac no Brasil apontaram eficácia de 78% para prevenir casos leves e 100% para casos graves e mortes. De acordo com o secretário estadual da Saúde de São Paulo, Jean Gorinchteyn, a gestão de João Doria (PSDB) divulgará nesta terça-feira 12 os dados da eficácia global da Coronavac.
Um minuto, por favor…
O bolsonarismo perdeu a batalha das urnas, mas não está morto.
Diante de um país tão dividido e arrasado, é preciso centrar esforços em uma reconstrução.
Seu apoio, leitor, será ainda mais fundamental.
Se você valoriza o bom jornalismo, ajude CartaCapital a seguir lutando por um novo Brasil.
Assine a edição semanal da revista;
Ou contribua, com o quanto puder.
Leia também
Dimas Covas: ‘Há seis milhões de doses de vacina na prateleira e isso não está sendo usado’
Por CartaCapital
Indonésia autoriza uso emergencial da Coronavac após eficácia de 65,3%
Por CartaCapital




