Saúde
Butantan pede autorização para uso emergencial da Coronavac
A partir de agora, a Anvisa tem um prazo de dez dias para se manifestar


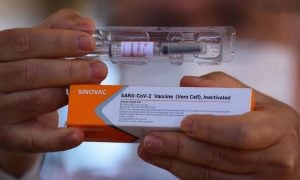
O Instituto Butantan protocolou na manhã desta sexta-feira 8, na Agência Nacional de Vigilância Sanitária, o pedido de autorização para uso emergencial da Coronavac, imunizante produzido em parceria com o laboratório chinês Sinovac.
A partir de agora, começa a valer o prazo de dez dias para a Anvisa analisar e se manifestar. O objetivo do governo de São Paulo é iniciar a vacinação no estado no dia 25 de janeiro.
Na última quinta-feira 7, o governo anunciou que a Coronavac registrou 78% de eficácia nos testes clínicos da fase 3.
Ainda ontem, o Ministério da Saúde, que até então apostava no imunizante da Astrazeneca/Oxford, assinou um contrato com o Butantan para adquirir até 100 milhões de doses da Coronavac. De acordo com a pasta, o acordo envolve a compra inicial de 46 milhões de unidades, prevendo a possibilidade de renovação com a aquisição de outras 54 milhões de doses posteriormente.
A Fundação Oswaldo Cruz também deve apresentar a solicitação para 2 milhões de doses da vacina que o governo federal negocia para importar da Índia.
Apoie o jornalismo que chama as coisas pelo nome
Depois de anos bicudos, voltamos a um Brasil minimamente normal. Este novo normal, contudo, segue repleto de incertezas. A ameaça bolsonarista persiste e os apetites do mercado e do Congresso continuam a pressionar o governo. Lá fora, o avanço global da extrema-direita e a brutalidade em Gaza e na Ucrânia arriscam implodir os frágeis alicerces da governança mundial.
CartaCapital não tem o apoio de bancos e fundações. Sobrevive, unicamente, da venda de anúncios e projetos e das contribuições de seus leitores. E seu apoio, leitor, é cada vez mais fundamental.
Não deixe a Carta parar. Se você valoriza o bom jornalismo, nos ajude a seguir lutando. Assine a edição semanal da revista ou contribua com o quanto puder.
Leia também
Coronavac e vacina de Oxford têm melhor custo-benefício para o Brasil, diz epidemiologista
Por Alisson Matos
Drauzio: ‘Ter medo da vacina é ridículo e, sendo um pouco rude, burrice’
Por Ana Luiza Basilio





